
猫用非甾体类药物该如何选择?
猫的急性和慢性疼痛很难治疗,因为:
◇某些药物猫的代谢比犬慢,可能会增加药物不良反应的风险1-3
◇容易出现肾功能逐渐下降;最近的一项研究发现,多达50%的猫可能患有慢性肾病4
◇可能难以用药并且经常抵制口服给药
◇通常不会表现出明显的疼痛或疾病的外在迹象,这使得评估药物疗效成为一项挑战,尤其是在忍痛的猫中5
◇当涉及到兽医批准的止痛药时,选择数量有限
NSAIDs 是用于治疗疼痛的最常见的药物类别之一,有大量信息表明 NSAIDs 可有效治疗猫的急性疼痛6,7。它们具有解热、镇痛和抗炎特性,这使它们成为有吸引力的治疗选择;但是,对于猫来说,还没有完全安全的非甾体抗炎药。
用于猫的理想 NSAID 的特征
1. 保留 COX-1 选择性抑制 COX-2
2. 提供有针对性的作用
√在靶组织中延长作用
√中枢神经系统作用的适当持续时间
√保留“非目标”组织
3. 可以轻松准确地进行管理
√提供注射剂和口服剂型,可互换
√简单的剂量测定和滴定
√可口且易于给药的口服形式
4. 在目标群体中显示出广泛的安全边际和循证临床安全性
√毒性研究表明猫的安全范围很广
√在目标群体中适当安全(例如,接受择期手术的猫)
5. 证明临床疗效的有力证据
√有效控制急性和术后疼痛
√有效缓解与慢性病相关的长期、适应不良的疼痛
1. 保留 COX-1 选择性抑制 COX-2
NSAID的作用是通过环氧合酶 (COX)抑制花生四烯酸产生前列腺素(参见前列腺素的作用)。COX酶有 2 种形式:
◇COX-1:通常是组成型的,参与保护胃粘膜和维持正常血小板功能和肾灌注的前列腺素的产生
◇COX-2:通常在炎症期间诱导,在愈合和疼痛信号中发挥作用;8然而,它的活性与某些组织的正常功能有关,例如肾脏、大脑和生殖系统。
理想的 NSAID 在 COX-1 和 COX-2 抑制之间取得平衡:
◇非选择性 COX 抑制剂同样抑制 COX-1 和 COX-2。9这些 NSAID 往往与经典的 NSAID 副作用有关,例如胃肠 (GI) 溃疡、厌食、呕吐、腹泻以及肾和肝毒性。10
◇在健康猫的初步研究中,选择性抑制 COX-2 的COX 抑制剂比非选择性 COX 抑制剂具有更大的安全范围。然而,这种更大的安全范围不适用于有胃肠道副作用风险的猫。
因此,理想的 NSAID 应该:
◇尽可能多地保留 COX-1
◇充分抑制 COX-2以有效对抗疼痛和炎症
◇保留足够的 COX-2以使其在正常的日常流程中发挥作用。
前列腺素的作用
所有器官和组织的日常功能和代偿功能都需要前列腺素。例如,前列腺素参与胃肠道溃疡的保护和愈合,以及正常肾功能和低血容量期间肾脏的代偿保护机制。10前列腺素是通过刺激神经在外周产生疼痛的主要因素。它们还参与了在脊髓背角水平的中枢敏化过程中有害刺激的促进和放大过程(图 1)。12 在兽医中,中枢敏化已被证明在外科手术后 24 小时内建立,并导致术后疼痛和可能的慢性疼痛。
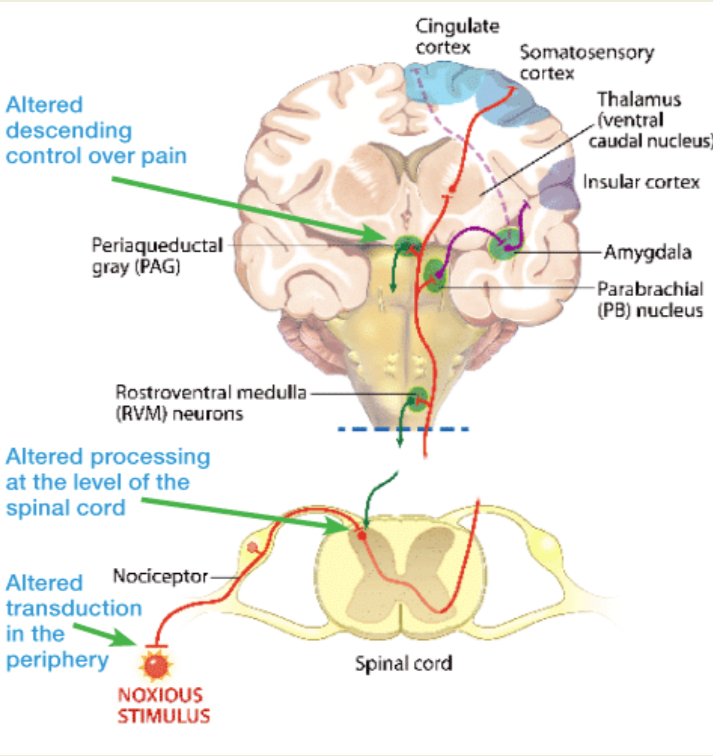
图 1. 前列腺素在外周作为疼痛纤维敏化剂的作用是众所周知的。它们还参与促进和放大中枢神经系统各个层次的疼痛信号;例如,在脊髓背角中发现的前列腺素有助于中枢敏化。此外,最近的信息表明,本地生产的前列腺素有助于降低参与控制疼痛的区域(内源性镇痛系统)的大脑功能。
2.提供针对性作用
目前的想法表明,理想的 NSAID 应该在炎症部位有较长的作用,而在中央区室的半衰期较短,从而限制正常、无炎症、无痛组织的暴露(图 2)。这是因为,鉴于前列腺素在整个身体中的广泛分布和作用,如果正常日常功能所需的前列腺素受到抑制,则可能会出现不必要的副作用。
NSAID 研究领域的领导者 Kay Brune 博士描述了“靶向组织选择性”的理论,该理论是酶特异性(选择性 COX-2 抑制)和组织选择性的结合,他认为这可能导致更好地耐受药物,同时保持疗效(参见组织选择性概念)。13
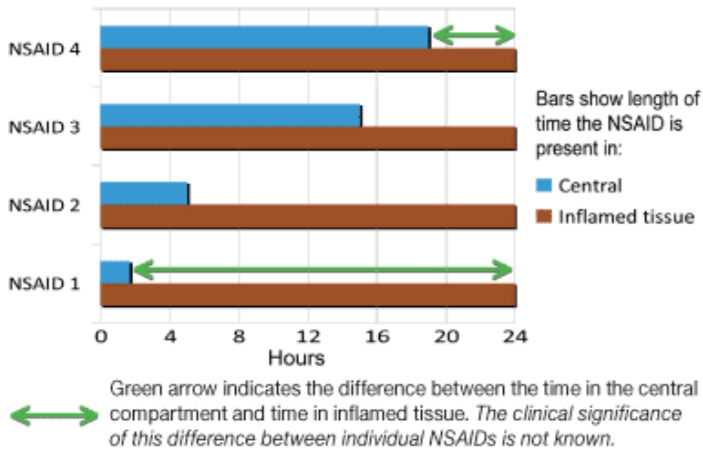
图 2. 该图说明了 4 个非甾体抗炎药实例之间的差异,每个实例每 24 小时给药一次。所有示例都显示了组织选择性,但具有不同的半衰期。NSAID 1 的半衰期很短,从中央隔室(血液)中迅速清除,因此理论上限制了非炎症组织的暴露。相比之下,NSAID 4 的半衰期相对较长,在 24 小时内的大部分时间里,非炎症组织都暴露于 NSAID 中。个体 NSAIDs 之间这种差异的临床意义尚不清楚。ay
组织选择性的概念
组织选择性是一个概念,涉及 NSAID 的高度蛋白质结合性质和炎症的酸性环境。
在炎症过程中,蛋白质从血管外渗或渗漏到细胞外环境中。由于已知非甾体抗炎药在正常生理 pH 值下具有“高度蛋白质结合”,如果服用了非甾体抗炎药,它将与该蛋白质结合。
发炎组织的酸性胞外环境中引起从蛋白质药物的解离,由于低的pKa-酸解离常数-的药物。药物与蛋白质分离后,活性药物游离部分的增加促进其进入细胞,然后由于离子捕获现象(由于细胞内和细胞内的 pH 值不同,药物被动进入细胞)而留在细胞中。)。13
这个理论解释了为什么非甾体抗炎药可能会在发炎组织中长期存在,同时从中央隔室(血流和其他非发炎器官)中的清除速度更快。14
3.轻松准确地管理
理想情况下,为了实现最佳的实际给药,NSAID 应该:
(1)提供可注射和可口的口服制剂
(2)易于滴定并具有易于确定的剂量
这两种配方应该是可用的,并被批准使用,可以互换。例如,当口服给药动物可能困难或不可能时,注射制剂有助于围手术期和术后即刻疼痛管理。然而,口服制剂有利于出院后的术后疼痛管理和长期慢性疼痛管理,因为它允许在家庭环境中给药。
特别是对于猫来说,适口的口服制剂有助于给药和依从性——疼痛管理的重要组成部分。猫对吃的东西有选择性,并且很难像狗一样在食物或零食中隐藏难吃的药丸或药物。如果猫不愿意服药,则必须对其进行限制和给药。
如有必要,NSAID 制剂应易于滴定,和/或具有易于确定的剂量。在片剂形式中,它应该具有宽的剂量范围,以允许整片给药,而不是为了保持在治疗范围内而分割片剂。
4.显示广泛的安全范围和循证临床安全性
首先,NSAIDs 的毒性研究应该证明在健康猫中具有稳定和广泛的安全范围。还没有人定义什么是广泛的安全范围,但鼓励兽医阅读各种 NSAID 的包装说明书和信息自由摘要。
此外,应该对非甾体抗炎药进行评估并认为它们在接受择期手术的正常猫中是适当安全的(这是一般实践中使用非甾体抗炎药的最常见情况。)理想情况下,这些信息应该采用同行评审文献的形式,这让临床医生对数据的有效性有一定程度的考察。
此外,在特定 目标群体中获得安全数据将是理想的,这些目标群体将从 NSAID 诱导的疼痛缓解中受益,包括患有慢性肾病或心肌病等并发疾病的猫。
可用于猫的非甾体抗炎药
美洛昔康
美洛昔康 (Metacam, us.boehringer-ingelheim.com) 已获得 FDA 批准,可用于猫作为术后疼痛的单次皮下注射。它是COX-2优先抑制剂的一个例子,其对 COX-2 的抑制作用比对 COX-1 的抑制作用更大。美洛昔康也被认为是组织选择性的,但它的半衰期长,因此在中央区室中的存在时间更长。
在2010年的共识指南:长期服用NSAIDs的猫(可在www.catvets.com/guidelines/practice-guidelines/nsaids-in-cats)提供了从猫医药(ISFM)和美国科学院国际协会建议Feline Practitioners (AAFP) 用于猫长期每日服用美洛昔康口服混悬液。16
参考文献
1.Lees P, Taylor PM. Pharmacodynamics and pharmacokinetics of flunixin in the cat. Br Vet J 1991; 147:298-305.
2.Taylor PM, Delatour P, Landoni FM, et al. Pharmacodynamics and enantioselective pharmacokinetics of carprofen in the cat. Res Vet Sci 1996; 60:144-151.
3.Parton K, Balmer TV, Boyle J, et al. The pharmacokinetics and effects of intravenously administered carprofen and salicylate on gastrointestinal mucosa and selected biochemical measurements in healthy cats. J Vet Pharmacol Ther 2000; 23:73-79.
4.Marino CL, Lascelles BD, Vaden SL, et al. Prevalence and classification of chronic kidney disease in cats randomly selected from four age groups and in cats recruited for degenerative joint disease studies. J Feline Med Surg 2013; epub ahead of print.
5.Robertson SA. Managing pain in feline patients. Vet Clin North Am Small Anim Pract 2008; 38:1267-1290.
6.King S, Roberts ES, Roycroft LM, et al. Evaluation of oral robenacoxib for the treatment of postoperative pain and inflammation in cats: Results of a randomized clinical trial. SRN Vet Sci 2012; doi: 10.5402/2012/794148.
7.Carroll GL, Howe LB, Peterson KD. Analgesic efficacy of preoperative administration of meloxicam or butorphanol in onychectomized cats. JAVMA 2005; 226:913-919.
8.Warner TD, Mitchell JA. Cyclooxygenases: New forms, new inhibitors, and lessons from the clinic. FASEB J 2004; 18:790-804.
9.Lees P, Landoni MF, Giraudel J, et al. Pharmacodynamics and pharmacokinetics of nonsteroidal anti-inflammatory drugs in species of veterinary interest. J Vet Pharmacol Ther 2004; 27:479-490.
10.Marino C, Lascelles BD, Vaden S, et al. The prevalence and classification of chronic kidney disease in a randomly selected group of cats and in cats with degenerative joint disease. J Feline Med Surg 2013; epub ahead of print.
11.Hsiang KW, Chen TS, Lin HY, et al. Incidence and possible risk factors for clinical upper gastrointestinal events in patients taking selective cyclooxygenase-2 inhibitors: A prospective, observational, cohort study in Taiwan. Clin Ther 2010; 32:1294-1303.
12.Eisenach JC, Curry R, Rauck R, et al. Role of spinal cyclooxygenase in human postoperative and chronic pain. Anesthesiology 2010; 112:1225-1233.
13.Brune K, Furst DE. Combining enzyme specificity and tissue selectivity of cyclooxygenase inhibitors: Towards better tolerability? Rheumatology (Oxford) 2007; 46:911-919.
14.Brune K. Persistence of NSAIDs at effect sites and rapid disappearance from side-effect compartments contributes to tolerability. Curr Med Res Opin 2007; 23:2985-2995.
15.Gruen ME, Griffith E, Thomson A, et al. Detection of clinically relevant pain relief in cats with degenerative joint disease associated pain. J Vet Intern Med 2014; 28:346-350.
16.Sparkes AH, Heiene R, Lascelles BD, et al. ISFM and AAFP consensus guidelines: Long-term use of NSAIDs in cats. J Feline Med Surg 2010; 12:521-538.
 |